国际首次!湖北科研团队找到癌症耐药复发关键“元凶”
北京时间1月22日凌晨,国际学术期刊《自然》(Nature)在线发表了华中农业大学生物医学与健康学院颜彦教授团队联合美国纪念斯隆–凯特琳癌症中心(MSKCC)Tuomas Tammela 教授团队合作完成的题为“Critical role for a high-plasticity cell state in lung cancer”的研究成果。
该研究通过构建一整套高度集成的新型小鼠遗传报告系统,首次精准定位并证实,在肺癌中存在着一类拥有“高可塑性细胞状态”的特殊肿瘤细胞,它们连接并调控着不同细胞状态之间的相互转变,如同肿瘤内部的“交通枢纽”,是驱动肺癌进展、造成肿瘤细胞多样性以及产生治疗耐受的关键源头。这项研究为理解癌症可塑性的组织规律提供了全新的理论框架,也为开发靶向肿瘤细胞状态转换的新型治疗策略奠定了重要基础。
恶性肿瘤之所以难治疗、易复发,一个根本原因是,肿瘤细胞非常“善变”——它们能在不同状态间来回切换,从而逃避药物等治疗手段的攻击而存活下来。
一直以来,科学界有个核心问题未被解答:在这些不断变化的细胞状态中,是否存在一个真正的“枢纽状态”,抓住它就能撼动全局?
由于缺乏能够在活体肿瘤中精准标记、长期追踪并对特定细胞状态进行功能干预的研究体系,该问题一直未能得到直接验证,也成为制约该领域发展的关键瓶颈。
针对这一挑战,研究团队开发了一套新型遗传报告系统,该系统能实现对特定肿瘤细胞状态的原位精准标记、纵向谱系追踪及定点特异性清除,相当于给肿瘤细胞装上了“可追踪芯片”和“定点清除开关”,为系统解析肿瘤细胞状态转换的因果关系提供了关键技术支撑。
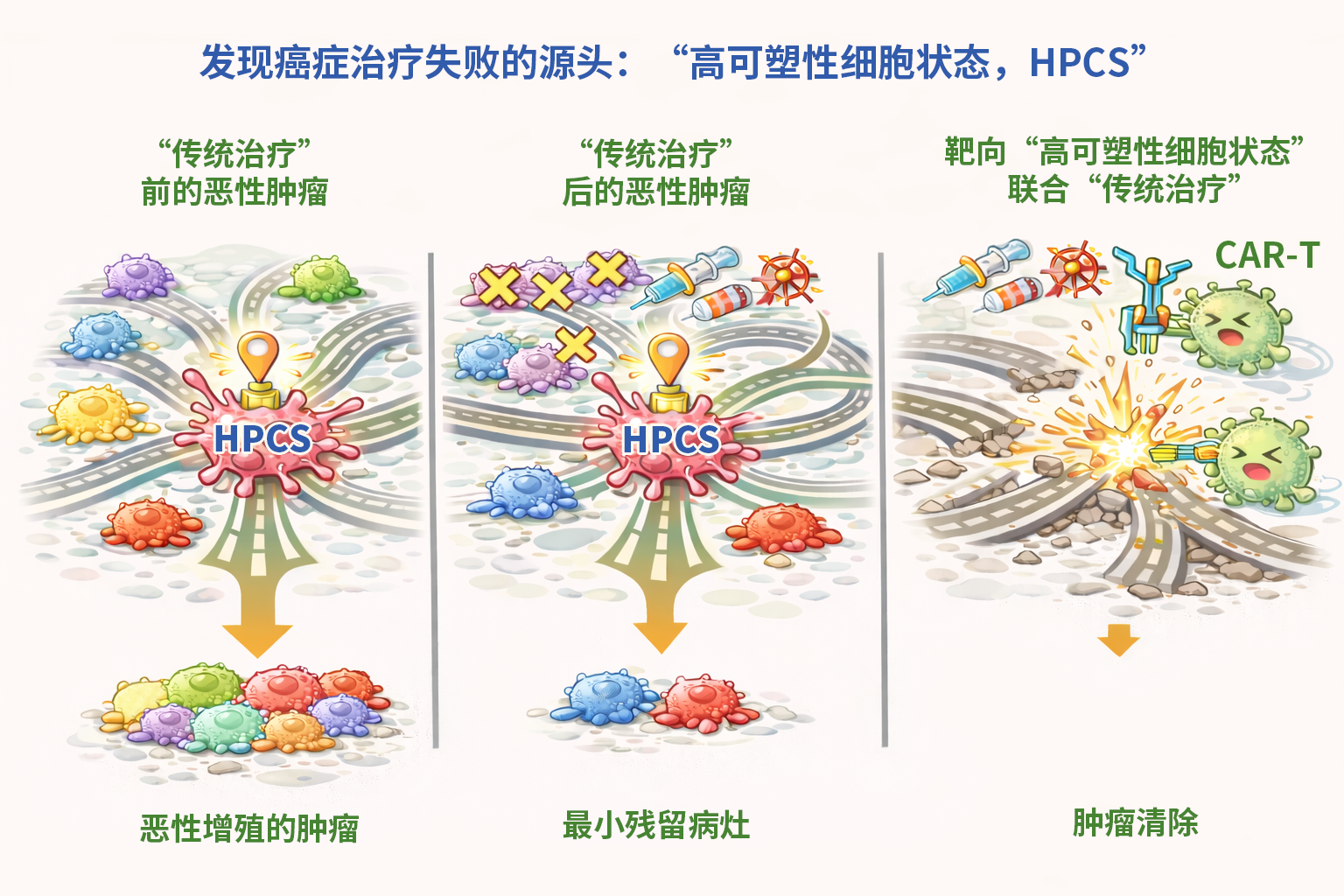
利用该项报告系统,研究团队鉴定出一类被称为“高可塑性细胞状态(HPCS)”的细胞群体:它们展现出惊人的“变身”能力——不仅能分化产生各种类型的肿瘤细胞,其他已分化的细胞在特定条件下也能“逆向”回归该状态,从而呈现出双向、非线性的可塑性特征。

颜彦介绍,如果把肿瘤比作一张动态的“交通网络”,不同细胞状态就像分布于其中的不同“城市区域”,而状态转换则如同连接各区的“公路系统”。研究发现,HPCS并非普通节点,而是位于中心的“交通枢纽”。细胞经此枢纽,可向不同分化路径“发车”,也可在特定条件下“回流”再次进入HPCS状态,从而持续维持肿瘤群体的异质性与演进潜能。该发现确立了HPCS作为肿瘤细胞状态转换与命运决定的关键枢纽。

有趣的是,HPCS本身并非处于高度增殖状态,而更像是一种保持“低活性预备”的细胞群体。一旦脱离该状态,这些细胞便会迅速启动增殖程序,成为直接驱动肿瘤生长的“主力”。这一发现揭示了一种有别于传统“癌症干细胞”理论的新组织原则:HPCS并非直接参与肿瘤扩张的“战斗单元”,而更像一个持续供应“高增殖潜能细胞”的“指挥中枢”,间接而持续地维持肿瘤进展。
进一步的研究表明,在肿瘤发生早期清除HPCS虽不影响肿瘤形成,却能有效阻断其向恶性阶段演进;而在已建立的晚期肿瘤中靶向清除该类细胞,则可显著抑制肿瘤生长。这些结果表明,HPCS不仅是肺癌由早期病变向恶性肿瘤转变的关键枢纽,也是晚期肿瘤维持异质性结构与增殖能力的细胞源头。
研究还发现,临床治疗后残留的、导致复发的“最小病灶”,主要就来源于这类HPCS细胞。
值得注意的是,该细胞状态高表达一种名为uPAR(尿激酶受体)的细胞表面蛋白,这相当于为其赋予了可被特异性识别的“分子标识”。基于此,研究团队采用靶向uPAR的“CAR-T免疫细胞”进行治疗,不仅成功清除了HPCS细胞,还能显著延缓肿瘤进展。更令人鼓舞的是,在动物实验中,如果靶向清除这类细胞,再配合常规化疗或靶向药,几乎能实现肿瘤的完全清除。
这一发现从功能层面挑战了“残留病灶不可避免”的传统观点,首次证实驱动治疗耐受的核心细胞状态具备可靶向性。
研究为肿瘤治疗指明了一条全新的路径:未来如果能够靶向这个控制肿瘤“善变”能力的枢纽,就有可能从根本上抑制肿瘤进化,为预防复发、战胜耐药,提供全新的治疗策略。
(长江云新闻记者 吴宝洪 程德明 通讯员 高雅婧 匡敏)







 融媒体平台建设服务
融媒体平台建设服务 长江云新时代文明实践平台
长江云新时代文明实践平台

 大数据舆情中心
大数据舆情中心